Uciszyć białko i wygrać z chorobą
Czy wystarczy wyciszyć aktywność konkretnych białek, by nie dopuścić do rozwoju wielu groźnych chorób, w tym Alzheimera? Artykuł o przełomowym odkryciu ukazał się właśnie w "PNAS", prestiżowym czasopiśmie amerykańskiej Narodowej Akademii Nauk. Jego pierwszą autorką jest dr Karolina Mikulska-Rumińska, biofizyk z UMK.
Zainteresowania naukowe dr Karoliny Mikulskiej-Rumińskiej z Katedry Biofizyki w Instytucie Fizyki UMK skupiają się wokół szeroko rozumianych struktur biologicznych, przede wszystkim białek. W swojej pracy stosuje głównie metody obliczeniowe wykorzystywane w symulacjach komputerowych. Już podczas podoktorskiego stażu na Uniwersytecie w Pittsburghu w grupie prof. Ivet Bahar rozpoczęła współpracę z lekarzami z Los Angeles oraz badaczami z Uniwersytetu w Pittsburghu.
O najnowszych efektach ich naukowych dociekań można przeczytać w opublikowanym właśnie przez "PNAS" artykule "Recruitment of pro-IL-1α to mitochondrial cardiolipin, via shared LC3 binding domain, inhibits mitophagy and drives maximal NLRP3 activation". Dr Mikulska-Rumińska i Jargalsaikhan Dagvadorj z Centrum Medycznego Cedars-Sinai w Los Angeles są pierwszymi autorami publikacji. Artykuł dotyczy mechanizmów działania układu odpornościowego w warunkach zapalnych.
- Jednym z głównych celów naszych badań było określenie roli, jaką pełni białko prointerleukina-1 alfa (pro-IL-1α). Wiadomo było, że forma dojrzała tej prozaplanej cytokiny (IL-1α) jest odpowiedzialna za powstawanie stanów zapalnych, gorączki i sepsy. Natomiast dużym odkryciem było to, że białko to już w formie nieaktywnego prekursora (pro-IL-1α) odgrywa tak kluczową rolę w regulacji odpowiedzi układu odpornościowego - tłumaczy dr Mikulska-Rumińska.
Groźny stan zapalny
Interleukiny (IL) są grupą cytokin, czyli białek biorących udział w procesach zapalnych układu odpornościowego. Białka te są numerowane – sklasyfikowano ich kilkadziesiąt. Dr Mikulską-Rumińską interesowała grupa pierwsza: IL-1. To zbiorcza nazwa, określająca cytokiny o kluczowym znaczeniu dla procesów zapalnych. Są wydzielane w odpowiedzi na różnego rodzaju antygeny, np. pochodzenia wirusowego, bakteryjnego bądź grzybicznego. Spośród 10 różnych wariantów do najbardziej istotnych należą wspomniana już IL-1α, występująca najczęściej jako cząsteczka błonowa i oddziałująca na komórki sąsiadujące oraz IL-1β. To właśnie one znalazły się w kręgu zainteresowań polskiej badaczki oraz naukowców amerykańskich.
W tym momencie należałoby powiedzieć o inflamasomie NLRP3. To wewnątrzkomórkowa struktura składająca się z wielu wyspecjalizowanych białek. W zdrowej komórce jest nieaktywna, a formę aktywną przybiera, gdy organizm jest zagrożony, np. przez obecność drobnoustrojów lub przez cząsteczki powstałe wskutek uszkodzeń tkanek i zaburzeń metabolicznych - tłumaczy dr Mikulska-Rumińska. Aktywne inflamasony NLRP3 przekształcają interleukinę 1 beta i interleukinę 18 w ich aktywną formę, wskutek czego aktywują zapalenie w organizmie.
- Oczywiście jest duża grupa stanów zapalnych, które są potrzebne organizmowi, np. by wyeliminować bakterie bądź wirusy. Przewlekły stan prowadzi jednak do wielu groźnych chorób. Najlepszym przykładem jest tzw. "burza cytokinowa", czyli nadmierna reakcja układu odpornościowego, z którą borykają się obecnie lekarze w najcięższych przypadkach COVID-19 - tłumaczy dr Mikulska-Rumińska. - Nadaktywność NLRP3 pociąga też za sobą liczne patologie, w tym np. miażdżycę, dnę moczanową, nieswoiste zapalenie jelit, reumatoidalne zapalenie stawów i cukrzycę typu 2.
Duża grupa naukowców z chronicznym stanem zapalnym wiąże też chorobę Alzheimera, czyli postępujące schorzenie neurodegeneracyjne, prowadzące do stopniowego zaniku funkcji poznawczych i pamięciowych. Mimo iż jej mechanizm patofizjologiczny nie został w pełni poznany, łączą go właśnie z aktywacją inflamasomu NLRP3.
Nasze badania ujawniają mechanizm, za pomocą którego komórki modulują aktywację inflamasomu NLRP3. To istotne, ponieważ wiąże się z potencjalnym zastosowaniem terapeutycznym, m.in. w leczeniu wyżej wymienionych chorób – mówi dr Mikulska-Rumińska.
- W skrócie: stwierdziliśmy, że komórki, w których nie występuje pro-IL-1α, charakteryzują się zmniejszoną aktywnością inflamasomu NLRP3 oraz aspazy-1 (tj. elementu inflamasomu, który aktywuje cytokiny). Prowadzi to do mniejszego uwalniania IL-1β i zmniejszenia uszkodzenia mitochondriów. Rola pro-IL-1α jest więc niezwykle istotna – reguluje aktywację inflamasomu, a więc jest kluczowym białkiem do zainicjowania stanu zapalnego - dodaje badaczka.
Współzawodniczące ze sobą białka
Naukowców zainteresowała jeszcze jedna kwestia. Dr Mikulska-Rumińska odkryła, że fragment pro-IL-1α, (tzw. peptyd sygnałowy) jest niezwykle podobny do innego białka - LC3b, które odgrywa kluczową rolę w oczyszczaniu organizmu z uszkodzonych bądź zbędnych komórek. Oba mają niemal identyczną sekwencję.
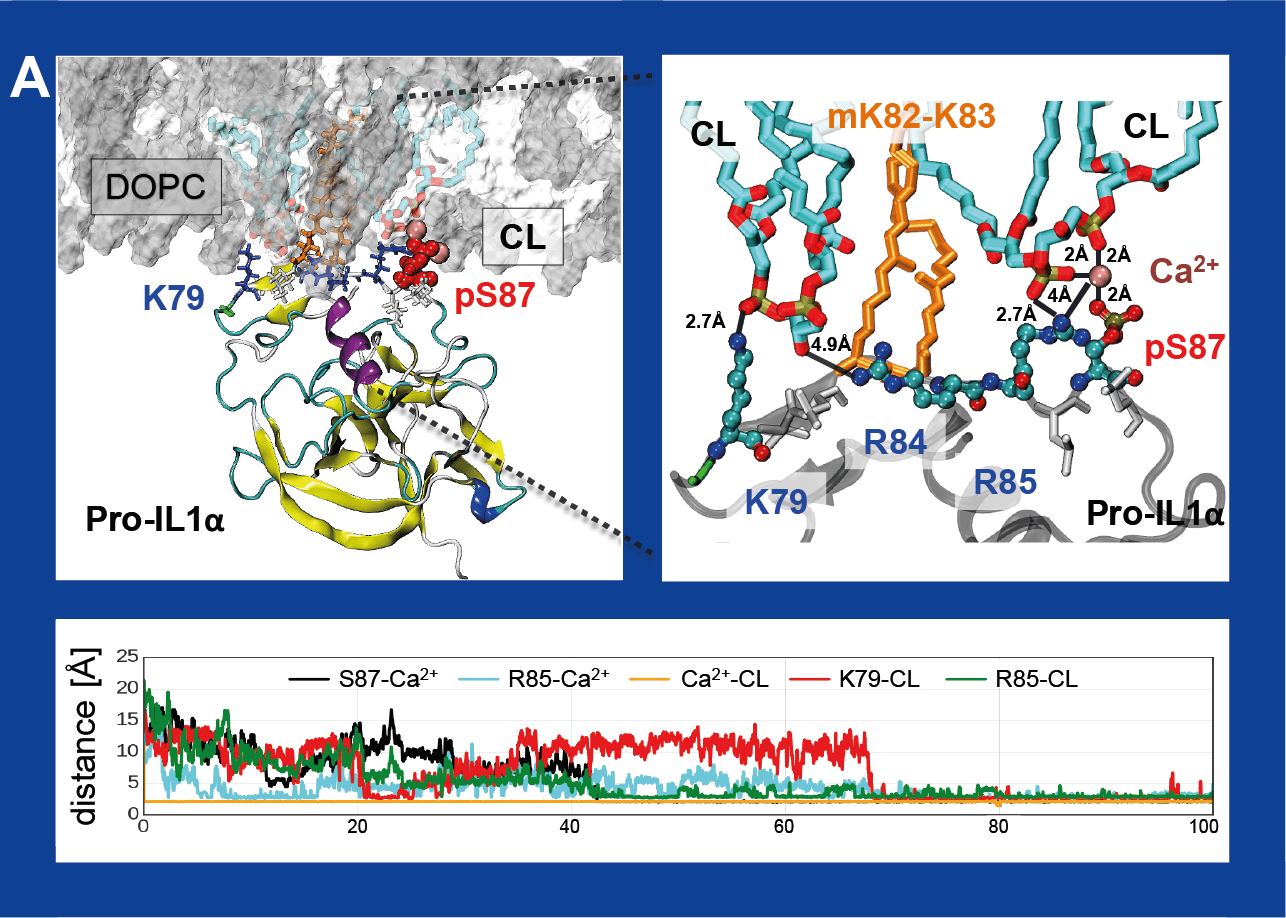
- Pokazaliśmy, że pro-IL-1α oddziałuje w błonie mitochondrium z kardiolipiną. Kardiolipina jest ważnym fosfolipidem, który normalnie łączy się z innym białkiem - LC3b, dając w ten sposób sygnał "zjedz mnie" do eliminacji komórek - tłumaczy dr Mikulska-Rumińska.
Symulacje dynamiki molekularnej dla takiego układu pokazały, jakie elementy strukturalne białka są kluczowe dla oddziaływań z kardiolipiną. Co więcej, okazało się, że te same elementy strukturalne są obecne w białku LC3b.
- Białka te mogą ze sobą współzawodniczyć, co może nieść za sobą groźne konsekwencje – tłumaczy dr Mikulska-Rumińska. - Gdy do kardiolipiny w komórce, np. uszkodzonej, przyłączy się pro-IL-1α, wówczas LC3b nie jest w stanie wykonać swojej pracy czyli zakomunikować organizmowi, że należy ją "wyrzucić". Dzieje się tak, ponieważ kardiolipina zostaje przechwycona przez pro-IL-1α i nie może już oddziaływać z LC3b.
To odkrycie również może przyczynić się do opracowania nowych strategii leczenia stanów zapalnych.
 Portal informacyjny
Portal informacyjny







 Nauki ścisłe
Nauki ścisłe
 Nauki ścisłe
Nauki ścisłe

 Nauki ścisłe
Nauki ścisłe