 Nauki ścisłe
Nauki ścisłe
Białka na rusztowaniu
Dr hab. Łukasz Pepłowski, prof. UMK z Instytutu Fizyki, wraz z naukowcami z Chin, zaproponował nową metodę zwiększania aktywności enzymów biotechnologicznych. Ma ona duże możliwości zastosowań w przemyśle.
Dr hab. Łukasz Pepłowski, prof. UMK z Katedry Biofizyki UMK (Instytut Fizyki, Wydział Fizyki, Astronomii i Informatyki Stosowanej) współpracował z chińskimi naukowcami ze School of Biotechnology, Jiangnan University w Wuxi - według ubiegłorocznego Rankingu Szanghajskiego uczelnia ta w dziedzinie biotechnologii zajmuje trzecie miejsce na świecie. Wyniki opisali w artykule A Versatile Protein Scaffold Engineered for the Hierarchical Assembly of Robust and Highly Active Enzymes, który ukazał się w cenionym czasopiśmie "The Advanced Science".
Projektowanie białkowych rusztowań
Praca prezentuje innowacyjne podejście do projektowania białkowych rusztowań, które umożliwiają hierarchiczną syntezę enzymów o zwiększonej stabilności i wydajności. Rusztowania białkowe zainspirowane zostały białkami nazywanymi gamma-prefoldinami. W pracy wykazano, że po ich pewnych modyfikacjach można otrzymać samoorganizujące się rusztowanie białkowe nazwane TERM ( thermophilic extension-resistant mutant), do którego przyczepić można enzymy.
- Naturalne enzymy, choć doskonale dopasowane do swoich funkcji, często charakteryzują się niską rozpuszczalnością, ograniczoną termostabilnością oraz trudnościami w ekspresji. Te cechy stanowią istotną przeszkodę w ich szerokim zastosowaniu w biotechnologii oraz przemyśle – tłumaczy prof. Łukasz Pepłowski.
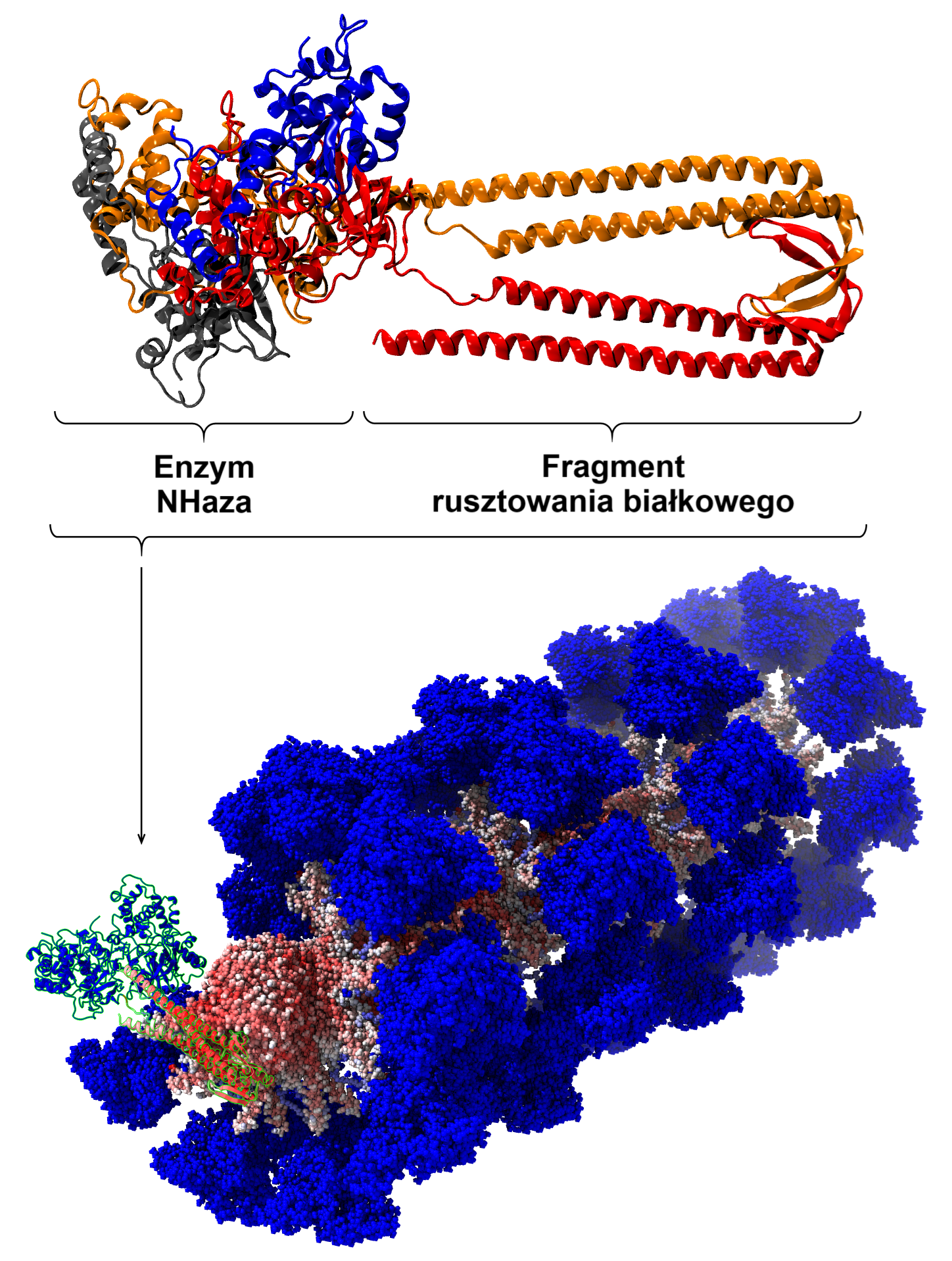
Hierarchiczny montaż enzymów na zaprojektowanym rusztowaniu białkowym odzwierciedla naturalne mechanizmy organizacji kompleksów wieloenzymatycznych, ale jednocześnie umożliwia znacznie większą kontrolę nad rozmieszczeniem poszczególnych jednostek.
Takie rozwiązanie otwiera nowe perspektywy w dziedzinie biokatalizy, syntezy chemicznej oraz zastosowań medycznych, gdzie wysoka efektywność i stabilność enzymów są kluczowe dla optymalizacji procesów przemysłowych – wyjaśnia prof. Pepłowski. - Wszechstronność prezentowanego rusztowania sprawia, że może ono zostać łatwo dostosowane do różnych systemów enzymatycznych, stanowiąc uniwersalną platformę dla budowy nowych, funkcjonalnych kompleksów białkowych.
Wszechstronne rusztowanie
Naukowcy powyższą wszechstronność udowodnili, umieszczając na rusztowaniu dwa całkowicie różne enzymy: xylanazę (z ang. xylanase), czyli małe jednodomenowe białko, katalizujące rozkład ksylanu – polisacharydu, który jest głównym składnikiem hemicelulozy w ścianach komórkowych roślin, oraz dobrze poznaną prof. Pepłowskiemu hydratazę nitrylową (NHaza z ang. nitrile hydratase, NHase). Przekształca ona toksyczne nitryle do użytecznych amidów, wykorzystywanych w produkcji ubrań (poliakryloamid), paszy dla zwierząt i kosmetyków (nikotynamid, czyli witamina PP) oraz m.in. dodatków do farb i sorbentów wody. NHaza jest dużym enzymem złożonym z czterech podjednostek i zawiera niestandardowe centrum katalityczne – białko to jest przez to wyzwaniem, jeśli chodzi o poprawę jego właściwości.
W artykule szczegółowo opisano etapy projektowania – od doboru bazowych struktur wygenerowanych za pomocą narzędzia AlphaFold (za które w 2024 roku przyznano Nagrodę Nobla w dziedzinie chemii), przez symulacje komputerowe dynamiki molekularnej i dokowania, aż po eksperymentalną walidację konstrukcji złożonych z rusztowania białkowego i umiejscowionym na nim enzymów.
Wyniki testów funkcjonalnych wykazały, że enzymy osadzone na rusztowaniu charakteryzują się wyższą aktywnością katalityczną i zwiększoną termostabilnością w porównaniu do ich naturalnych odpowiedników czy też wcześniejszych wariantów opracowanych metodami konwencjonalnymi – tłumaczy prof. Pepłowski. - Metodami dynamiki molekularnej i dokowania wyjaśniono natomiast, dlaczego enzymy osadzone na rusztowaniu wykazują się zwiększoną aktywnością i termostabilnością. Kluczowe jest gęste upakowanie enzymów oraz wzajemne oddziaływania pomiędzy poszczególnymi podjednostkami enzymów, a także oddziaływanie enzymu z rusztowaniem, co powoduje, że taki enzym trudniej ulega denaturacji i częściej zachowuje swoją natywną, zdolną do pracy strukturę.
Wyniki badań dają duże pole do ich zastosowań przede wszystkim w biotechnologii oraz przemyśle.
 Portal informacyjny
Portal informacyjny








 Nauki ścisłe
Nauki ścisłe
 Nauki ścisłe
Nauki ścisłe